LATIHAN 1
5.5 Stoikiometri Gas
Contoh 5.11Hitung volume O₂ (dalam liter) yang dibutuhkan untuk pembakaran total 7,64 L asetilena (C₂H₂) yang diukur pada suhu dan tekanan yang sama.
2C₂H₂(g) + 5O₂(g) → 4CO₂(g) + 2H₂O(l)
2 mol 5 molStrategi
Perhatikan bahwa suhu dan tekanan O₂ dan C₂H₂ adalah sama. Hukum gas mana yang diperlukan untuk menghubungkan volume gas dengan mol gas?
Penyelesaian
Menurut hukum Avogadro, pada suhu dan tekanan yang sama, jumlah mol gas secara langsung berkaitan dengan volumenya. Dari persamaan, ada 5 mol O₂ ∞ 2 mol C₂H₂; oleh karena itu, dapat ditulis 5 L O₂ ∞ 2 L C₂H₂. Volume O₂ yang akan bereaksi dengan 7,64 L C₂H₂ diberikan oleh
5.6 Hukum Dalton Tentang Tekanan Parsial
Contoh 5.15
Gas oksigen yang dihasilkan dari penguraian kalium klorat dikumpulkan seperti yang ditunjukkan pada Gambar 5.15. Volume oksigen yang dikumpulkan pada 24°C dan tekanan atmosfer 762 mmHg adalah 128 mL. Hitung massa (dalam gram) gas oksigen yang diperoleh. Tekanan uap air pada 24°C adalah 22,4 mmHg.
Strategi
Untuk menyelesaikan massa O₂ yang dihasilkan, pertama-tama harus dihitung tekanan parsial O₂ dalam campuran. Hukum gas apa yang dibutuhkan? Bagaimana mengubah tekanan gas O₂ menjadi massa O₂ dalam gram?
Penyelesaian
Dari hukum Dalton tentang tekanan parsial, diketahui bahwa
PT = PO₂ + PH₂O
Sehingga
PO₂ = PT ₋ PH₂O
= 762 mmHg - 22,4 mmHg
= 740 mmHg
Dari persamaan gas ideal dapat dituliskan
di mana m dan ℳ masing-masing adalah massa O₂ yang dikumpulkan dan massa molar O₂. Dengan menyusun ulang persamaan didapatkan
5.7 TEORI KINETIK GAS
Contoh 5.16
Strategi
Penyelesaian
Menggunakan faktor konversi 1 J = 1 kg m²/s² didapatkan
Hitung akar rata-rata kuadrat kecepatan dari atom helium dan molekul nitrogen dalam m/s pada 25°C.
Strategi
Untuk menghitung akar-rata-rata-kuadrat kecepatan diperlukan Persamaan (5.16). Satuan apa yang harus digunakan untuk R dan ℳ supaya 𝒗rms diekspresikan dalam m/s?
Penyelesaian
Untuk menghitung 𝒗rms, satuan R harus 8,314 J/K⠂mol dan, karena 1 J = 1 kg m²/s², massa molar harus dalam kg/mol. Massa molar He adalah 4,003 g/mol, atau 4,003 x 10⁻³ kg/mol. Dari persamaan (5.16),
Menggunakan faktor konversi 1 J = 1 kg m²/s² didapatkan
Prosedurnya sama untuk N₂, massa molar adalah 28,02 g/mol, atau 2,802 x 10⁻² kg/mol sehingga dapat dituliskan
5.8 PENYIMPANGAN DARI PERILAKU GAS IDEAL
Contoh 5.18
Strategi
Penyelesaian
(a) Kita memiliki data berikut:
V = 5,20 L
T = (47 + 273) K = 320 K
n = 3,50 mol
R = 0,0821 L . atm/K . mol
a = 4,17 atm . L²/mol²
b = 0,0371 L/mol
sehingga faktor koreksi untuk tekanan dan volume adalah
Mengingat bahwa 3,50 mol NH₃ menempati 5,20 L pada 47°C, hitung tekanan gas (dalam atm) menggunakan (a) persamaan gas ideal dan (b) persamaan van der Waals.
Strategi
Untuk menghitung tekanan NH₃ menggunakan persamaan gas ideal, kita melanjutkan seperti pada Contoh 5.3. Koreksi apa yang dibuat untuk faktor tekanan dan volume dalam persamaan van der Waals?
Penyelesaian
(a) Kita memiliki data berikut:
V = 5,20 L
T = (47 + 273) K = 320 K
n = 3,50 mol
R = 0,0821 L . atm/K . mol
Dengan mensubstitusi nilai-nilai ini ke dalam persamaan gas ideal, kita mendapatkan
(b) Kita perlu Persamaan (5.18). Lebih mudah untuk pertama kali menghitung faktor koreksi dalam Persamaan (5.18) secara terpisah. Dari Tabel 5.4, kita memiliki
a = 4,17 atm . L²/mol²
b = 0,0371 L/mol
sehingga faktor koreksi untuk tekanan dan volume adalah
Akhirnya, dengan mensustitusi nilai-nilai ini ke dalam persamaan van der Waals, kita mendapatkan
(P + 1,89 atm)(5,20 L - 0,130 L) = (3,50 mol)(0,0821 L.atm/K.mol)(320 K)
P = 16,2 atm
KUIS 1
5.5 STOIKIOMETRI GAS
5.54 Metana merupakan komponen utama gas alam yang digunakan untuk pemanasan dan memasak. Proses pembakaran seperti persamaan berikut :Langkah yang harus dilakukan pertama kali adalah mengecek apakah reaksi sudah setara atau belum. Apabila sudah reaksi sudah setara, selanjutnya adalah menghitung mol CO2 dengan menggunakan rumus perbandingan koefisien dan perbandnigan volume :
Selanjutnya adalah menghitung volume gas CO2 dengan rumus seperti di bawah ini:
5.6 HUKUM DALTON TENTANG TEKANAN PARSIAL
5.67 Campuran gas mengandung 0,31 mol CH4, 0,25 mol C2H6, dan 0,29 mol C3H8. Tekanan total 1,50 atm. Hitunglah tekanan parsial masing- masing gas !
Diketahui :
Ditanya : Tekanan parsial masing masing gas ?
Pembahasan :
Hal yang pertama kali kita lakukan adalah menghitung fraksi mol masing masing gas.
- Tekanan Parsial Gas C3H8
5.7 TEORI KINETIK GAS
5.82 Suhu di stratosfer adalah 223 °C Hitung Vrms molekul O2, N2, dan O3 di wilayah ini !
Diketahui :
Ditanya : Vrms molekul O2, N2, dan O3 ?
Pembahasan :
Hal yang pertama kali kita lakukan sebelum menentukan Vrms masing -masing molekul adalah menghitung massa molar dari masing masing molekul.
- Massa Molar N2
5.8 PENYIMPANGAN DARI GAS IDEAL
5.94 Pada 27°C, 10,0 mol gas dalam wadah 1,50 L memberikan sebuah tekanan 130 atm. Tentukanlah apakah gas ini termasuk gas ideal atau bukan ?
Diketahui :
Ditanya : Tentukanlah apakah gas ini termasuk gas ideal atau bukan?
Pembahasan :
Untuk menentukan apakah gasi itu merupakan gas ideal. kita akan menghitung faktor kompresibilitas Z. Jika Z mendekati atau sama dengan 1, maka gas itu merupakan gas ideal.




















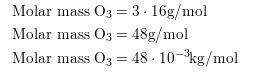







No comments:
Post a Comment