LATIHAN 8
1. Kelarutan Mg(OH)2 dalam air adalah 2 x 10-4 mol/L, maka Ksp Mg(OH)2..
a. 4 x 10-11
b. 3,2 x 10-6
c. 4 x 10-9
d. 3,2 x 10-11
e. 8 x 10-11
Pembahasan
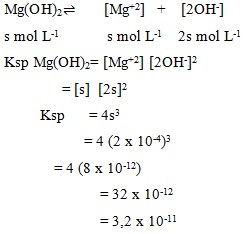
Jawaban : D
2. Gas A,B, dan C masing-masing 0,4 mol, 0,6 ,mol, dan 0,2 mol dicampurkan dalam ruang tertutup dan terjadi reaksi kesetimbangan:
![]()
Pada saat setimbang 0,3 mol gas A telah bereaksi, maka gas B yang ada dalam keadaan setimbang adalah…
a. 0,5 mol
b. 0,4 mol
c. 0,3 mol
d. 0,2 mol
e. 0,1 mol
Pembahasan :
Dengan menggunakan perbandingan koefisien maka :
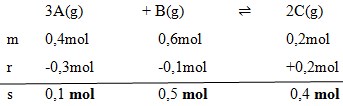
Jawaban : A
a. 3,0 x 10-7 mol L-1
b. 3,22 x 10-9 mol L-1
c. 3,28 x 10-9 mol L-1
d. 6,56 x 10-10 mol L-1
e. 16,4 x 10-10 mol L-1
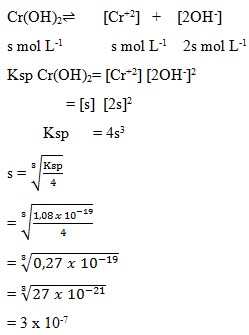
Jawaban : A
4. Gas N2 dengan volume 10 ml direaksikan dengan 25 ml gas H2, membentuk reaksi setimbang:
![]()
Volume akhir pada saat setimbang tercatat 25 ml (diukur pada P dan T yang sama). Volum gas NH3 yang terjadi pada saat setimbang adalah…
a. 5 ml
b. 10 ml
c. 15 ml
d. 35 ml
e. 40 ml
Pembahasan :
Diketahui :
V = 10 ml
Vt = 25 ml
V H2 = 25 ml
Dengan menggunakan perbandingan koefisien maka :
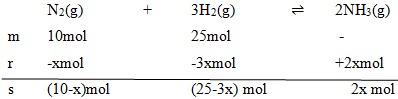
Vt = 25 ml
(10-x) + (25-3x) + 2x = 25
35 – 2x = 25
35 – 25 = 2x
10 = 2x
x = 5
jadi saat setimbang volume gas NH3 yaitu 2x = 2 . 5 = 10 ml
Jawaban : B
KUIS 8
- CHAPTER 13
1. Suatu reaksi kimia yang berlangsung pada suhu 30°C memerlukan waktu 40 detik. Setiap kenaikan suhu 10°C, reaksi akan lebih cepat dua kali dari semula. berapakah waktu yang diperlukan jika suhu dinaikkan menjadi 50°C…
a. 30 detik
b. 20 detik
c. 15 detik
d. 10 detik
e. 5 detik
Jawaban : D
Pembahasan :
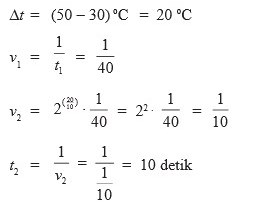
2. Reaksi gas bromin dengan gas nitrogen oksida sesuai dengan persamaan reaksi:
2 NO(g) + Br(g) → 2NOBr(g)
Berdasarkan hasil percobaan diperoleh data sebagai berikut
| No. | Konsentrasi Awal (M) | Laju reaksi awal (M/det) | |
| [NO] | [Br2] | ||
| 1. | 0,1 M | 0,05 M | 6 |
| 2. | 0,1 M | 0,1 M | 12 |
| 3. | 0,2 M | 0,05 M | 24 |
| 4. | 0,3 M | 0,05 | 54 |
Tentukan Harga tetapan reaksi k.

Jawaban : A

- CHAPTER 14
3. dalam suatu ruangan 10 liter pada suhu 7°C terdapat dalam keadaan kesetimbangan 1 mol NH3, 2 mol O2, 2 mol NO dan 2 mol uap air menurut persamaan.
![]()
Harga tetapan kesetimbangan reaksi pada suhu tersebut adalah . . . . . .
a. 0,25
b. 0,5
c. 3,2
d. 32
e. 64
Pembahasan :

Jawaban : E
4. Pada reaksi kesetimbangan :
PCl5 (g) ↔ PCl3 (g) + HCl (g)
Pada suhu 27°C mempunyai nilai Kc = 0,04. Nilai Kp pada kesetimbangan tersebut adalah..
a. 0,0885
b. 0,0984
c. 0,885
d. 0,984
e. 1,080
Jawaban : D
Pembahasan :
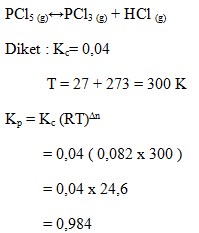
- CHAPTER 15
5. Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw = 10-14)…….
a. 5 X 10-10
b. 5 X 10-18
c. 0,2 X 10-10
d. 0,2 X 10-8
e. 2 X 10-10
Pembahasan:
Dalam larutan dengan pelarut air, berlaku :
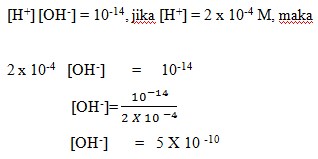
Jawaban: A
6. Larutan asam lemah NH4OH 0,1 M,dan Kb = 10-5 , nilai pH larutan tersebut adalah… . .
a. 11
b. 3
c. 9
d. 14
e. 6
Pembahasan:
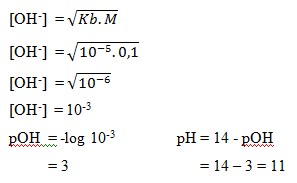
Jawaban : A
- CHAPTER 17
7. Perubahan entalpi dari reaksi manakah yang berikut ini dapat disebut dengan perubahan entalpi pembentukan ΔHf° Na2SO4 kristal….
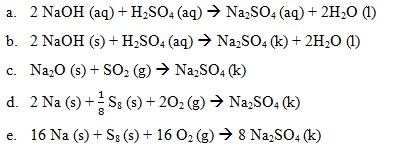
Pembahasan:
Perubahan entalpi pembentukan standar merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan stabil, pada 25°C dan tekanan 1 atm. Perubahan entalpi pembentukan standar suatu zat ditentukan dengan menggunakan rumus:
ΔHfo reaksi = ∑ ΔHf° hasil – ∑ΔHf° pereaksi
Reaksi pembentukan ΔHf° Na2SO4
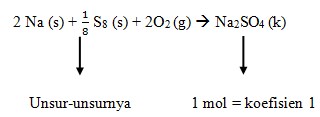
Jawaban : D
8. Entalpi pembakaran asetilena adalah -1300 kJ, entalpi pembentukan asetilena, C2H2 adalah….
(ΔHf° CO2 = -395 ; ΔHf° H2O = -285 )
a. -225 kJ
b. +225 kJ
c. -450 kJ
d. +450 kJ
e. -620 kJ
Pembahasan :

Jawaban : B
- CHAPTER 18
a. 317,5
b. 635,0
c. 952,5
d. 1.270
e. 1.905
Jawaban : B
Pembahasan :
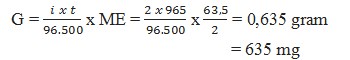
10. Reaksi :
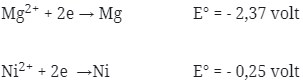
Potensial yang dihasilkan oleh reaksi Mg + NiCl2 → MgCl2 + Ni adalah …
a. -2,12 volt
b. +2,12 volt
c. +1,06 volt
d. -2,62 volt
e. +0,80 volt
Perhatikan E° nya ! logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi). Sudah pasti bahwa Mg adalah anode (mengalami oksidasi) dan Ni adalah Katode (mengalami reduksi).
Pada soal reaksi tidak berbentuk ion, berarti NiCl2 dan MgCl2 dipecah lagi sehingga menghasilkan ion.
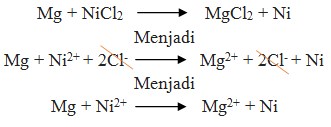
= – 0,25 – (- 2,37 )
= + 2,12 volt


No comments:
Post a Comment