LATIHAN 3
1. Berikut merupakan persamaan reaksi pembentukan gas SO3:
SO2(g) + O2(g) → SO3(g)
Jika gas oksigen yang digunakan sebanyak 12 L, maka volume gas SO3 yang dihasilkan adalah....
A. 6 liter
B. 12 liter
C. 18 liter
D. 24 liter
E. 36 liter
Pembahasan:
Persamaan reaksi setara untuk penguraian gas SO3 adalah sebagai berikut:
2SO2 (g) + O2 (g) → 2SO3 (g)
Menurut hukum Gay Lussac, perbandingan volume spesi dalam reaksi fase gas sebanding dengan koefisien spesi tersebut.
Jika volume gas O2 = 12 L, maka:

2. Dua mol gas N2 pada suhu 27oC memiliki tekanan 1 atm. Volume gas tersebut adalah ….
A. 50 dm3
B. 40 dm3
C. 30 dm3
D. 20 dm3
E. 10 dm3
Pembahasan :
3. Suatu gas ideal menempati volume 100 cm3 pada suhu 0oC dan tekanan 1 atm. Bila suhunya menjadi 50oC sedangkan tekanan menjadi 2 atm, volume gas menjadi ….
A. 118,3 cm3
B. 84,5 cm3
C. 59,2 cm3
D. 45,5 cm3
E. 38,4 cm3
Pembahasan :
Diketahui :
T1 = 0oC + 273 = 273 K
T2 = 50oC + 273 = 323 K
3. Suatu gas ideal mula-mula menempati ruang yang volumenya V pada suhu T dan tekanan P. Jika gas dipanaskan sehingga suhu gas menjadi 3/2 T dan tekanan menjadi 4/3 P maka volume gas menjadi….
A. 9/5 V
B. 5/3 V
C. 3/2 V
D. 4/3 V
E. 9/8 V
Pembahasan
Diketahui :
Volume awal gas (V1) = V
Suhu awal gas (T1) = T
Suhu akhir gas (T2) = 3/2 T
Tekanan awal gas (P1) = P
Tekanan akhir gas (P2) = 4/3 P
Ditanya : Volume akhir gas (V2)
Jawab :
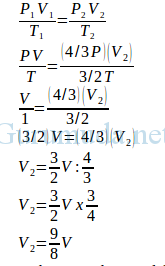
4. Suatu gas ideal mula-mula menempati ruang yang volumenya V pada suhu T dan tekanan P. Jika suhu gas menjadi 3/2 T dan tekanannya menjadi 2 P, maka volume gas menjadi ….
A. 3/4 V
B. 4/3 V
C. 3/2 V
D. 3 V
E. 4 V
Pembahasan:

Pembahasan:
Jawaban : A
V = 5,20 L
T = (47 + 273) K = 320 K
n = 3,50 mol
R = 0,0821 L . atm/K . mol
- CHAPTER 1
d =
d = 0,5 gram/cm3
d = 0,5 x 1000 kg/m3
d = 500 kg/m3
Jadi, densitas bola tersebut adalah 500 kg/m3
- CHAPTER 2
1. Pada isotop unsur ![]() , jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
, jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Pembahasan :
![]()
- X = lambang unsur
- Z = jumlah proton
- N = nomor atom
- M = massa atom
- Neutron = A – Z
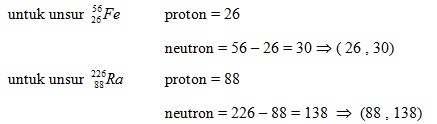
Jawaban : C
A. 18 neutron dan 18 proton
B. 22 neutron dan 22 proton
C. 40 proton dan 18 elektron
D. 18 proton dan 22 neutron
E. 18 neutron, 22 proton, dan 22 elektron
Pembahasan :
Nomor atom suatu unsur menunjukkan banyaknya proton atau banyaknya elektron. Sedangkan banyaknya neutron adalah Nomor Massa dikurangi
Nomor Atomnya.
![]() berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
- CHAPTER 3
A. 260 gram
B. 250 gram
C. 240 gram
D. 230 gram
E. 220 gram

A. 144
B. 96
C.72
D. 68
E. 46
Penyelesaian :
Mr XSO4 = Ar X + Ar S + 4 Ar O
gr/mol = Ar X + 32 + 4 . 16
72 / 0,5 = Ar X + 32 + 64
144 = Ar X + 98
Ar X = 144 - 98 = 46
Jawaban: E
- CHAPTER 4
A. 16
B. 6
C. 1
D. 4
E. 12
Pembahasan :

Jawaban : B
- CHAPTER 6
n HBr = 11,2 = 0,5 mol
A. 592,2 kJ
B. 5922 kJ
C. 59,22 kJ
D. 5,922 kJ
E. 59220 kJ
Pembahasan :
- CHAPTER 7
[Ar] 3d5.
Jika atom X memiliki neutron sebanyak 30, atom X tersebut memiliki nomor massa . . . .
A. 28
B. 31
C. 56
D. 60
E. 63
Pembahasan
Ion X+3 berarti telah melepaskan 3 buah elektronnya. Jika kita lihat dari konfigurasinya maka electron yang dilepaskan itu berasal dari 2 buah electron orbital 4s dan 1 buah electron orbital 3d (lihat konfigurasinya : [Ar] 3d5 , sub kulit 3d berpasangan dengan sub kulit 4s)
Sehingga konfigurasi elektronnya adalah :
[Ar] 4s2 3d6
Jumlah electron = 18 + 2 + 6 = 26
Jumlah proton = 26
Nomor massa = p + n = 26 + 30 = 56
A. 20Ca2+
B. 22Ti2+
C. 24Cr2+
D. 25Mn2+
E. 26Fe2+
24Cr : [Ar] 3d4 4s2 maka untuk menjadi ion Cr2+ harus melepas 2 elektron pada kulit terluarnya.
Jadi konfigurasi elektronnya sekarang : [Ar] 3d4.
- CHAPTER 8
A. IIA dan 6
B. VIB dan 3
C. VIB dan 4
D. VIIIB dan 3
E. VIIIB dan 4
Pembahasan :
Menentukan letak unsur
![]()
Ingat bahwa 4s 3d merupakan salah satu karakteristik konfigurasi elektron unsur golongan B. Dari konfigurasi di atas diperoleh :
n = 4 → periode 4
eval (s+d) = 2 + 6 = 8 → golongan VIIIB
Jawaban : E
2. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur X adalah… (nomor atom Ar = 18, Kr = 36, Ne = 10)
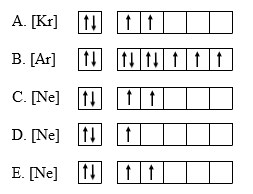
Pembahasan :
konfigurasi elektron aturan Hund.
Melihat opsi jawaban pada soal di atas, maka yang harus kita lakukan adalah menentukan susunan elektron dalam unsur X berdasarkan aturan Hund dan menghubungkannya dengan unsur-unsur yang diketahui pada soal.
Karena no atom unsur X adalah 13, maka unsur yang mungkin digunakan untuk menyatakan konfigurasi elektron X adalah Ne dengan nomor atom 10. Secara sederhana, konfigurasi kedua unsur itu dapat kita tulis sebagai berikut :
10Ne : 2 8
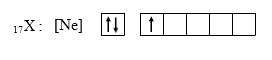
13X : 2 8 3 → 13X : [Ne] 3
Selanjutnya berdasarkan aturan Hand, maka diagram orbital unsur X adalah sebagai berikut :
- CHAPTER 9
HCl Gas – Gas 2 atom tidak sejenis : polar Kovalen polar
NaCl Logam – Gas Ion
NH3 Gas – Gas PEI = 3 N golongan V A PEB = 5 – 3 = 2 Kovalen polar
H2O Gas – Gas PEI = 2 O golongan VI A PEB = 6 – 2 = 4 Kovalen polar
PCl3 Gas – Gas PEI = 3 P golongan V A PEB = 5 – 3 = 2 Kovalen polar
Jawaban : B
- CHAPTER 10
- CHAPTER 11
Maka tidak terjadi polaritas ikatan pada senyawa CCl4. Serta persebaran elektron pun menjadi merata untuk setiap ikatannya. Oleh karena itu senyawa CCl4 ini merupakan senyawa yang bersifat nonpolar.
- CHAPTER 12
A. Tekanan uap jenuh lebih tinggi daripada tekanan uap jenuh pelarut
B. Titik beku larutan lebih tinggi daripada titik beku pelarut
C. Tekanan osmosis larutan lebih rendah dari tekanan osmosis pelarut
D. Titik didih larutan lebih tinggi daripada titik didih pelarut
E. Titik didih pelarut lebih tinggi dari pelarutnya
Jawaban : D
Pembahasan
Keberadaan zat terlarut dalam pelarut dapat mengakibatkan terjadinya kenaikan titik didih larutan,karena terjadinya penurunan tekanan uap larutan oleh keberadaan zat terlarut tersebut. Sehingga dibutuhkan kenaikan temperatur untuk menaikkan tekanan uap larutan sehingga sama dengan tekanan eksternal.
2. Peristiwa berikut ini :
- (1) Pembentukan delta pada muara sungai
- (2) Pemurnian gula pasir
- (3) Penyembuhan sakit perut oleh norit
- (4) Penjernihan air
Merupakan contoh koagulasi koloid adalah …
A. 1 dan 2
B. 1 dan 3
C. 1 dan 4
D. 2 dan 3
E. 2 dan 4
Pembahasan :
Koagulasi merupakan suatu keadaan dimana partikel-partikel koloid membentuk suatu gumpalan yang lebih besar.penggumpalan ini dikarenakan oleh beberapa faktor antara lain karena penambahan zat kimia atau enzim tertentu.
Contoh peristiwa koagulasi :
- Pembentukan delta muara sungai
- Penggumpalan karet dalam lateks dengan asam format
- Penggumpalan lumpur koloidal dalam air sungai dengan t awas
- Koagulasi asap atau debu dengan koagulator listrik








No comments:
Post a Comment